Received: ноябрь, 2011
Fluorine Notes, 2011, 79, 7-8
1-Ферроценил-1-трифторметил-2,2,2-трифторэтиловый эфир метакриловой кислоты – новый мономер для полимерной химии
В.И.Дяченко, Л.Н.Никитин, О.А.Мельник, С.М.Перегудова, А.С.Перегудов, С.М.Игумнов, А.Р.Хохлов
Институт элементоорганических соединений им. А.Н.Несмеянова РАН, Российская Федерация, 119991,
ГСП-1, Москва, В-334, ул. Вавилова, 28,
e-mail: vic-d.60@mail.ru
Аннотация. Реакцией 1-ферроценил-1-трифторметил-2,2,2-трифторэтилового спирта и хлорангидрида метакриловой кислоты в присутствии гидрида натрия в безводном диметилформамиде был получен соответствующий 1-ферроценил-1-трифторметил-2,2,2-трифторэтиловый эфир метакриловой кислоты. Установлена его способность к обратимому окислению-восстановлению, радикальной (со)полимеризации в сверхкритическом диоксиде углерода и органических растворителях.
Ключевые слова: 1-ферроценил-1-трифторметил-2,2,2-трифторэтиловый спирт, хлорангидрид метакриловой кислоты, 1-ферроценил-1-трифторметил-2,2,2-трифторэтиловый эфир метакриловой кислоты, полимеризация.
Известно, что фторсодержащие полимеры, в отличие от нефторированных аналогов, обладают большей липофильностью и гидрофобностью, высокой устойчивостью к окислению, действию кислот и агрессивных сред. Благодаря этим ценным свойствам все больше возрастает их экспансия в материаловедение, электронику, автомобилестроение, оптико-волоконную промышленность, каждодневный обиход [1]. Однако современное инновационное развитие экономики на основе нанотехнологий требует создания материалов, не только обладающих защитными свойствами или конструкционными особенностями, а веществ, несущих те или иные функциональные свойства. Среди них - полимеры, обладающие протонной или электронной проводимостью, материалы, преобразующие солнечную энергию в электрическую, сополимеры, выполняющие функции сенсорных систем, средств избирательной доставки лекарств в клетку-мишень человека [2].
На протяжении последних лет все больше возрастает интерес исследователей к полимерам на основе ферроцена. Вызван он главным образом тем, что ферроцен, помимо структурных особенностей молекулы, обладает одним из наиболее низких потенциалов окисления. Причем окисление его молекулы не носит деструктивный характер и связано лишь с изменением валентности входящего в его состав железа (Fe2+ на Fe3+). Образовавшийся таким образом ферроцений-катион при действии восстановителя снова легко превращается в исходный ферроцен, меняя при этом цвет с синего на желтый [3].
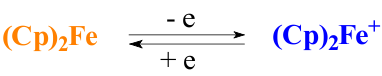
В этой связи оказалось весьма успешным использование редокс-процесса на основе производных ферроцена в практике создания сенсорых систем [4,5].
Одним из подходов к созданию биосенсоров является включение в состав полимера редокс-медиаторов, обеспечивающих контакт фермента и электрода. Поэтому очень важна стабилизация медиатора в полимерном слое. То есть он должен иметь группу, привязывающую его к полимерной матрице. В этой связи были получены ферроценсодержащие амфифильные производные пиррола типа Ia, которые могут химически прививаться к цепи при электрохимической полимеризации пиррола [6-8] (см. Рис. 1). При создании глюкозных биосенсоров к силикатной основе были привиты соответствующие кремнийсодержащие редокс-медиаторы Ib [9].
Рис. 1.
С целью получения органических полиэлектролитов были синтезированы азотсодержащие мономеры 1,1'-бис(N,N-диметиламинометил)- и 1,1'-бис[1-(2-метилимидазол-1-ил)метил]ферроцены (IIa,IIb) для сополимеризации с 1,4-дибромбутаном и α,α-дибром-р-ксилолом [10]. Для изучения электрохимических свойств недавно были получены ферроценсодержащие (мет)акрилаты (IIIa-IIIc) и полимеры на их основе [11]. C использованием 1,1-бис(хлорформил)ферроцена синтезированы фосфорсодержащие жидкокристаллические полимеры [12].
Целью настоящего исследования является синтез нового фторсодержащего метакрилата, несущего в качестве редокс-медиатора ферроценильную группу (см. Схему 1) и изучение его физико-химических свойств.
Схема 1.
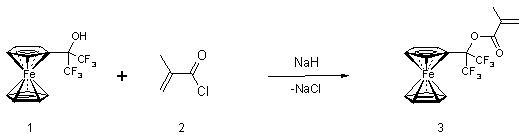
Исходный 1-ферроценил-1-трифторметил-2,2,2-трифторэтанол (1) [13] получали из промышленно доступных гексафторацетона и ферроцена по ранее описанной методике [14]. Взаимодействием спирта (1) с хлорангидридом метакриловой кислоты (2) был получен соответствующий 1-ферроценил-1-трифторметил-2,2,2-трифторэтилметакрилат (3). Реакция 1 и 2 легко осуществляется в безводном ДМФА в присутствии гидрида натрия, образуя 3 с хорошим выходом. Метакрилат 3 представляет собой кристаллическое красно-оранжевое вещество, растворимое практически во всех органических растворителях и стабильное при хранении. Он легко (со)полимеризуется в растворе в присутствии инициатора радикальной полимеризации - азоизобутиронитрила при 60-70°С.
С использованием метода циклической вольтамперометрии (ЦВА) были изучены электрохимические свойства метакрилата 3 (см. Рис. 2). Показано, что окисление 3 осуществляется в одну обратимую одноэлектронную стадию. Потенциал окисления (E1/2= +0.63В) сдвинут в положительную область потенциалов по сравнению с ферроценом (E1/2= +0.40В) на 230мВ, что свидетельствует об электроноакцепторном характере фторсодержащего заместителя.
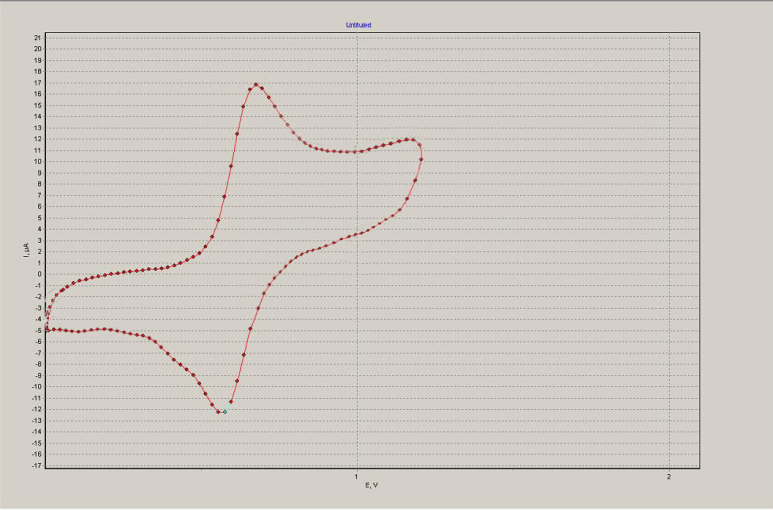
Рис. 2. Циклическая вольтамперограмма 3 (растворитель – ацетонитрил, фоновый электролит - 0,1М Bu4NPF6 , рабочий электрод - стеклоуглерод, вспомогательный электрод – Pt, электрод сравнения – нас.к.э. )
Экспериментальная часть
Спектры ПМР зарегистрированы в СDCl3 на приборе Bruker AvanceTM 600 (600.22 MHz), спектр ЯМР 19F - на приборе Bruker AvanceTM 300 (282,40 MHz ). В качестве внутреннего стандарта использовали Me4Si (1H и 13С), внешний стандарт – СF3CO2H (19F). Масс-спектр зарегистрирован на квадрупольном масс-спектрометре FINNIGAN MAT INCOS 50. Прямой ввод, энергия ионизации 70 эВ.
1-Ферроценил-1-трифторметил-2,2,2-трифторэтиловый эфир метакриловой кислоты 3. К раствору 3,52 г (10 ммоль) спирта 1 в 25 мл безводного ДМФА в стеклянной колбе при 20°С и перемешивании на магнитной мешалке по частям прибавляли 0,24 г (10 ммоль) 60%-ного гидрида натрия в вазелиновом масле. По окончании выделения водорода в реакционную массу прибавляли 10 мг ионола и затем по каплям 1,14 г (11 ммоль) метакрилоилхлорида 2, поддерживая при этом температуру 20°С. После прибавления 2 содержимое колбы перемешивали еще 1 час и выливали в 150 мл холодной воды. Продукт реакции экстрагировали петролейным эфиром (50 мл х 2), раствор сушили безводным сульфатом натрия и упаривали в вакууме. Продукт реакции выделяли методом колоночной хроматографии, элюент – гексан. Получали 2,9 г красно-оранжевого масла, кристаллизующегося при охлаждении. Выход 69%. Т.пл. 58-59°С (петролейный эфир). Спектр ЯМР 1H ( δ, м.д.): 1,95 (с, 3Н, CH3); 4,24 (уш.с, 5Н, С5Н5); 4,37 (уш.с, 2Н, 2СН, (С5Н4), 4,46 (уш.с, 2Н, 2СН, (С5Н4), 5,71 (с, 1Н, CH2), 6,20 (с, 1Н, CH2). Спектр ЯМР 19F (δ, м.д.): 8,64 с. Масс-спектр, m/z): [M]+(420). Найдено (%): С, 48,74; Н, 3,40; F, 26,90. С17H14F6FeО2. Вычислено (%): C, 48,60; Н, 3,36; F, 27,13.
Электрохимические исследования проводили в атмосфере сухого аргона в 0,1М растворе Bu4NPF6 в ацетонитриле. Измерения проводили в трехэлектродной электрохимической ячейке с неразделенным катодным и анодным пространством. Потенциалы измеряли относительно водного насыщенного каломельного электрода (нас. к.э.).Вспомогательным электродом служила платиновая пластинка, расположенная в ячейке. В качестве рабочего электрода использовали торцевую часть стеклоуглеродного стержня (площадь диска составляла 2мм2). Циклические вольтамперограммы регистрировали с использованием потенциостата IPC-Pro M. Скорость развертки потенциала составляла 200 мВ/с. Концентрация исследуемого соединения 1.10-3М.
Таким образом, синтезирован новый мономер для полимерной химии - 1-ферроценил-1-трифторметил-2,2,2-трифторэтилметакрилат. Показана его способность к (со)полимеризации в условиях радикальной инициации c образованием "side-chain" ферроценсодержащих полимеров. Изучены его физико-химические свойства. Установлено его обратимое одноэлектронное окисление-восстановление, что подтверждает возможность его использования в качестве антиоксидантной добавки в полимеры, способной прививаться к полимерной цепи. В перспективе эти особенности 3 также могут быть использованы для создания биосенсорных тест-систем.
Работа выполнена при финансовой поддержке Программы П7 Президиума РАН и гранта РФФИ # 11-03-12068-офи-м 2011 года.
Список литературы
- Соединения фтора. Синтез и применение, ред. Н.Исикава, перевод с яп., М.: Мир, 1990.
- Программа Международого форума по нанотехнологиям «Rusnanotech 2011», Москва, 2011 г.
- А.Н.Несмеянов. Ферроцен и родственные соединения. М.: Наука, 1982.
- R.Deschenaux, Polym. Mater. Sci. Eng., 2002, 86, 97.
- F.Turpin, D.Guillon, R.Deschenaux, Mol. Cryst. Liq., Cryst. Sci. Technol. Sect. A, 2001, 362, 171-175.
- S.Cosnier, Biosens. Bioelectron., 1999, 14, 443-456.
- S.Cosnier, C.Innocent, Y.Jouanneau, Anal. Chem., 1994, 66, 3198-3201.
- (a) S.Cosnier, L.Allien, L.Coche-Guérente, C.Innocent, P.Labbé, P.Mailley, Sens. Mater., 1996, 8, 169-177; (b) S.Cosnier, B.Galland, C.Innocent, J. Electroanal. Chem., 1997, 433, 113-119.
- (a) J.Gun, O.Lev, Anal. Chim. Acta, 1996, 336, 95-106; (b) J.Gun, O.Lev, Anal. Lett., 1996, 29, 1933-1938].
- Ye Gao and Jean'ne M.Shreeve, Journal of Polymer Science, Part A: Polymer Chemistry, 2005, 43, 5(1), 974–983.
- C.G.Hardy, L.Ren, T.C.Tamboue, C.Tang, Journal of Polymer Science, Part A: Polymer Chemistry, 2011, Vol. 49, 1409–1420.
- S.Senthil, P.Kannan, Journal of Polymer Science, Part A: Polymer Chemistry, 2001, 39, 14, 2396-2403.
- M.I.Bruce, F.G.Stone, B.I.Thomson, J. Organomet. Chem., 1974, 77, 1, 77
- В.И.Дяченко, А.Ф.Коломиец, А.В.Фокин, Тезисы доклада V Всесоюзной конференции по металлоорганической химии, Рига, 1991.
Материал рекомендован к публикации членом редколлегии С.Р. Стерлиным
Fluorine Notes, 2011, 79, 7-8
